从设计到验证—CRISPR基因敲除细胞株实战案例


CRISPR/Cas9 是源于细菌和古菌的适应性免疫系统。科学家将其改造为强大的基因编辑工具,其核心组件包括:
向导RNA(sgRNA):约20个碱基的序列,负责特异性识别并结合目标DNA位点。
Cas9 核酸酶: 在 sgRNA 引导下,精准切割靶DNA双链,产生双链断裂(DSB)。
CRISPR/Cas9 的划时代意义在于其设计简便(仅需设计sgRNA序列)、成本低廉、编辑效率高且可同时靶向多个基因位点(多重编辑)。其中,基因敲除(Knockout, KO) 作为其最核心、应用最广泛的功能,已成为解析基因功能、构建疾病模型、开发新型疗法的基石工具。
基因敲除的核心原理
CRISPR/Cas9本身不直接“删除”基因,而是巧妙地利用细胞自身的DNA损伤修复机制来实现基因功能的永久性失活:
针对编码基因
-
精准打击: sgRNA引导Cas9在目标基因的关键功能区域(如编码蛋白基因的5’端核心外显子)制造DSB。
-
修复路径选择- NHEJ主导: 面对DSB,细胞主要有两种修复途径:需要同源模板的高保真修复(HDR)和快速但易错的非同源末端连接(NHEJ)。在缺乏修复模板的常规条件下,NHEJ是绝大多数细胞的首选修复机制。
-
NHEJ的“错误”成就: NHEJ修复过程并非完美,常在断裂点处引入随机的、小片段的碱基插入或缺失(Insertions/Deletions, Indels)。
-
移码突变:当这些Indels发生在基因的蛋白质编码区(外显子),且插入或缺失的碱基数不是3的整数倍时,将导致后续所有密码子的阅读框发生偏移,即移码突变(Frameshift Mutation)。移码突变几乎必然在短时间内产生提前终止密码子(Premature Stop Codon)。
-
基因功能的彻底瓦解:无义介导的mRNA降解(NMD): 细胞质中的NMD机制能高效识别并降解含有提前终止密码子的异常mRNA,导致目标基因的转录本水平急剧下降。
-
功能蛋白缺失: 即使有少量截短蛋白侥幸翻译产生,其结构也必然残缺不全,完全丧失正常生物学功能。至此,目标基因被功能性敲除。
非编码基因或大片段DNA
若要删除特定区域(如整个基因、特定功能域、调控元件或病毒序列),需在目标片段上下游边界各设计一条高特异性的sgRNA。共转Cas9和这两条sgRNA,在基因组上同时产生两个DSB。细胞在进行NHEJ修复时,倾向于将两个相距较远的断端直接连接起来,从而精确删除两个切割位点之间的DNA大片段。这是一种高效、定向的“基因手术”。
案例分享—基因敲除单克隆细胞株构建
泓迅生物利用CRISPR/Cas9基因编辑技术的原理,使用电转法敲除人胰腺癌细胞系(MIA PaCa-2)的目的基因,再分离培养单个细胞进行单克隆化,扩增培养后通过PCR及测序验证,获得目的基因敲除的阳性单克隆。
1、在需求敲除片段两端分别设计1条高靶向的sgRNA序列。

2、将gRNA-A1、gRNA-A2进行化学修饰合成后分别与Cas9蛋白组装成RNP,单克隆化培养与扩增。
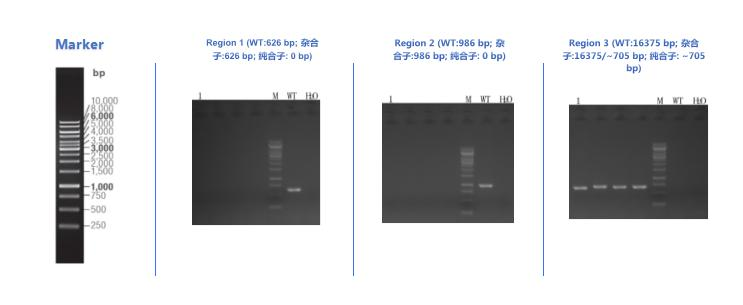
3、三级PCR鉴定(Region 1/2/3)
单克隆1B4通过PCR鉴定为纯合子。
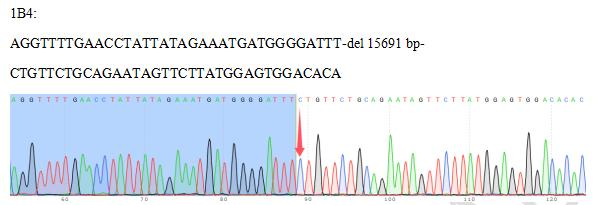
4、Sanger测序验证
DNA水平-Sanger测序显示,靶区间检测到15691 bp大片段缺失。
泓迅生物成功构建目的基因纯合敲除的MIA PaCa-2单克隆细胞株(1B4),经多级分子验证及无菌质检,符合标准细胞株交付要求。该模型适用于膜融合机制、胰腺癌分泌通路等研究。
CRISPR/Cas9介导的基因敲除已成为功能基因组学研究和基因治疗开发的基石技术。其高效性、便捷性和可扩展性极大地加速了我们对基因功能的理解,并为治疗遗传性疾病、感染性疾病(如艾滋病)和癌症提供了革命性的工具。然而,脱靶效应、体内递送瓶颈及复杂基因调控需求等挑战将推动技术持续迭代,最终实现更安全有效的基因治疗临床应用。
泓迅生物——细胞基因编辑一站式服务
泓迅生物全新推出继质粒DNA后CRISPR RNP介导的细胞基因编辑服务:平台依托先进的技术和经验丰富的科研团队,打造从方案设计、sgRNA设计及化学合成、高活性重组Cas9蛋白,RNP复合物组装到敲除细胞系构建的全流程服务。
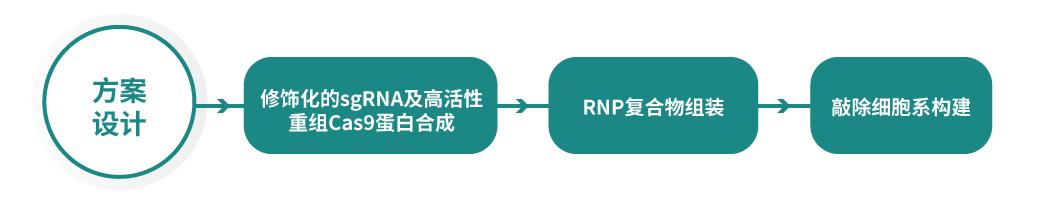
方案设计-合成-细胞系构建一体化服务
-
全模式物种 CRISPR sgRNA 设计
-
sgRNA 化学合成纯度高达99%以上
-
重组Cas9蛋白纯度高达99%以上
-
最快至2周交付
为什么选择泓迅
领先的技术优势—AI赋能的合成生物学技术
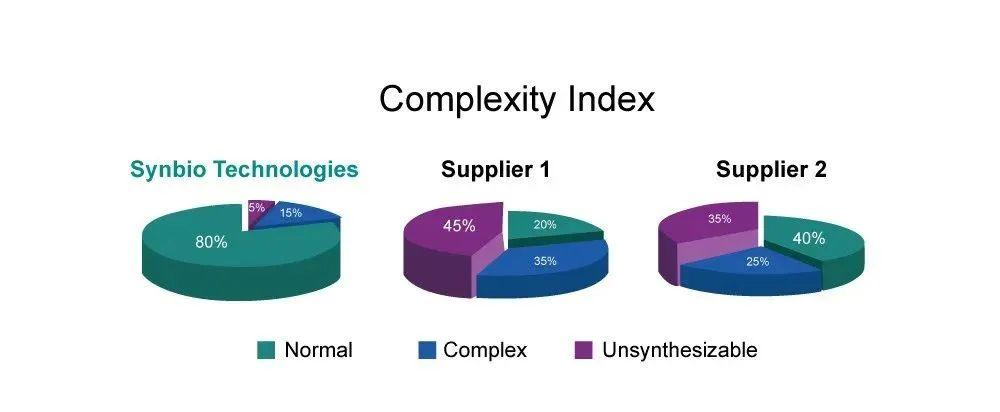
我们可以做—高难度的序列合成
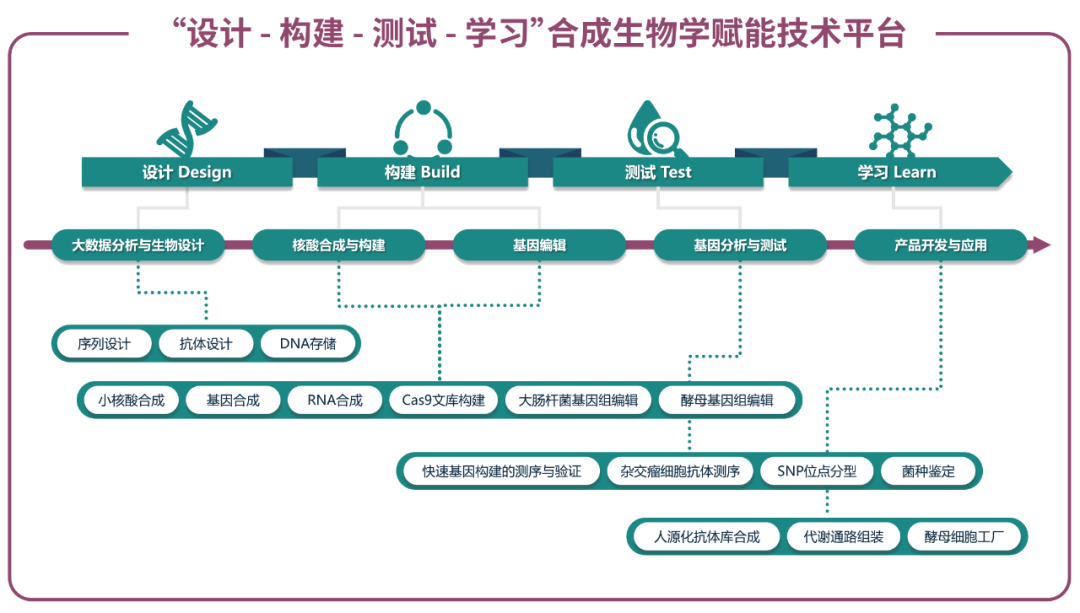
更高的价值服务—一站式合成生物学解决方案
 Syno®C 引物合成
Syno®C 引物合成 RNA合成
RNA合成 mRNA合成
mRNA合成 Syno®GS 基因合成
Syno®GS 基因合成 载体构建
载体构建 高通量及DNA文库构建
高通量及DNA文库构建 CRISPR基因编辑平台
CRISPR基因编辑平台 病毒包装
病毒包装 基因测序及分析
基因测序及分析 重组蛋白表达平台
重组蛋白表达平台 抗体工程平台
抗体工程平台 多肽服务
多肽服务 生物信息学分析与设计
生物信息学分析与设计 CRISPR文库
CRISPR文库 合成生物学产品
合成生物学产品 ProXpress蛋白快速检测
ProXpress蛋白快速检测 CRISPR 质粒
CRISPR 质粒





















